Bilde 1. Elektrisk DNA (kreditt: Nogas1974 (Eget verk) [ CC BY-SA 4.0 ], via Wikimedia Commons).
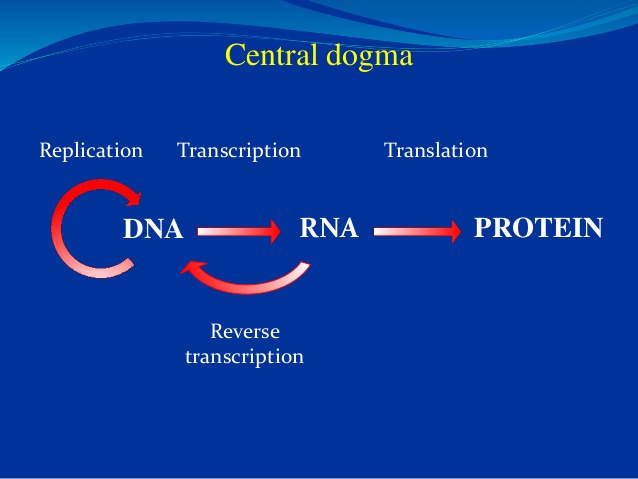
Ved fullføring av Human Genome Project, ble forskere forbløffet over det uventet lave antall gener. Hvordan kunne så få proteinkodende gener (ca 20.000) bygge et menneske? Det viste seg at gener er bare en del av handlingen. Den gamle Sentral-dogmet som viste DNA som master molekyl, RNA som budbringeren og proteinet som sluttprodukt er borte for lengst. Nå begynner vi å se at det er tre "-omes" som samhandler på komplekse måter med andre molekyler, inkludert lipider og sukker. Overalt de vender seg, ser forskerne molekylær trolldom på jobb. Her er noen få ferske eksempler.
 En annen -Ome med en egen kode
En annen -Ome med en egen kode
‘The Bellvitge Biomedical Research Institute’ (IDIBELL) fra Barcelona, Spania, antar vi kjenner til genomet og epigenomet. Nå trekker nyheter fra IDIBELL oppmerksomheten til et annen "-Ome" som øker i betydning: transkriptOmet, med henvisning til "epigenetikken i RNA":
"Det er velkjent at DNA noen ganger produserer en RNA-streng, men så er ikke dette RNA opphav til proteinet. Fordi endringen i disse tilfellene verken er i genomet eller proteomet, trodde vi det skulle være i transkriptomet, det vil si i RNA-molekylet", forklarer Dr. Esteller." I de senere årene, oppdaget vi at vårt RNA er svært regulert og om bare to eller tre modifikasjoner på DNA-nivå kan styre det, kan det være hundrevis av små forandringer i RNA som styrer dens stabilitet, dets intracellulære lokalisering eller dets modning i levende vesener". [Vekt tilsatt.]
Bilde 2. 'Sentraldogmet'
For eksempel, er noen ikke-kodende RNA nå kjent for å være ‘vokter-RNA' i henhold til modifikasjonene på deres baser eller sukker med metylgrupper som fungerer som ‘merker’ (tags). Feltet ‘transcriptomics’ er bare omtrent fem år gammelt. "Det vil definitivt være en spennende forskningsarena for denne og neste generasjon av forskere," sier Dr. Esteller. Se vår siste artikkel "RNA Code Surpassing DNA in Complexity" – på norsk her for mer om dette ‘episentriske karma’ som overkjører Sentraldogmet.
Elektrisk DNA
Her er en annen måte som DNA bærer informasjon som er ganske sjokkerende: det leder strøm. Science Magazine -her, beskriver "DNA styrer transporten" som et uventet signaleringssystem mellom koden og dets lesemaskiner.
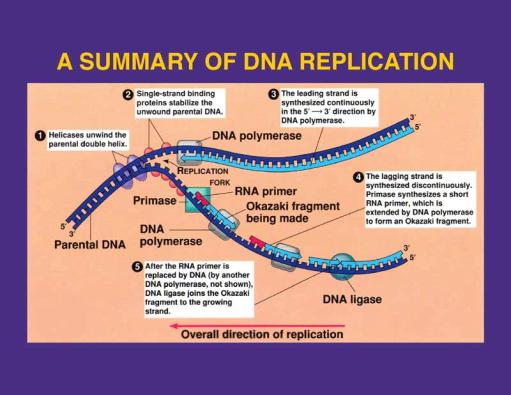
“DNA-styrt (charged) transport gir en vei for hurtig, langtrekkende signalering mellom redoks-aktive grupper koblet inn i DNA-dupleks. Flere enzymer integrert i eukaryotisk DNA-replikasjon inneholder [4Fe4S] klynger, vanlige redoks-kofaktorer. DNA-primase, enzymet som er ansvarlig for å initiere replikasjon av enkelt-trådet DNA, er et [4Fe4S] protein. Primase syntetiserer korte RNA-primere med en nøyaktig lengde før overlevering av den viktigste DNA-templaten til DNA-polymerase α, et annet [4Fe4S] enzym. 4Fe4S-klyngen i primase er nødvendig for primer syntese, men dets underliggende kjemi er ikke fastslått. Dessuten, hva som arrangerer primer omruting mellom primase og DNA-polymerase α er ikke godt forstått”.
I artikkelen, forteller sju forskere fra Caltech og Vanderbilt om forsøkene de kjørte for å etablere eksistensen av elektrisk ladde overføringer mellom dobbeltspiralen og molekylære maskiner som leste og kopiere det. "Vi viser at oksydasjonstilstanden av [4Fe4S] klyngen i DNA-primase virker som en reversibel av / på-bryter for DNA-binding", konkluderer de. Og den er ikke alene. Fordi DNA kan utføre overføringer over lange avstander, "En slik redox-signalisering av [4Fe4S] bunter kan spille en større rolle i polymerase-enzymer for å koordinere eukaryotisk DNA-replikasjon."
 Sirkulær RNA
Sirkulær RNA
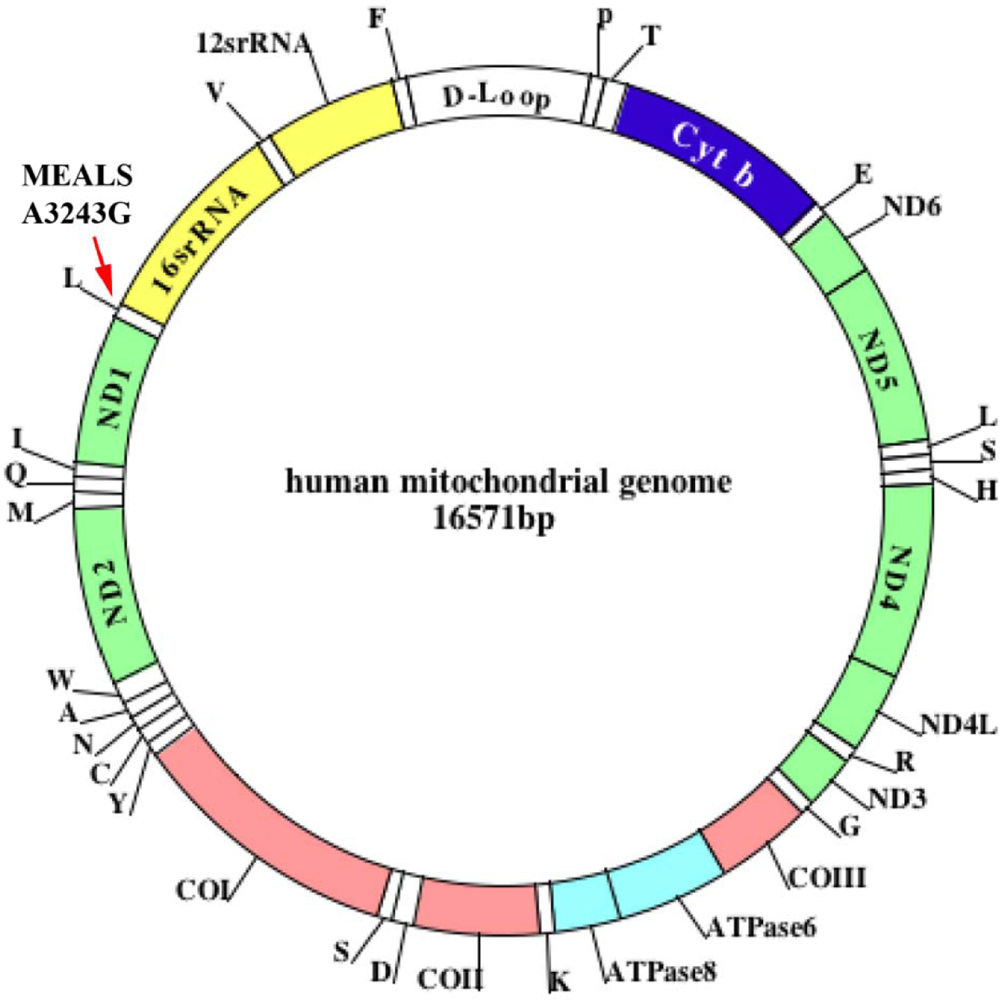
Noen RNA folder seg i stabile sløyfer. Vi har dem i hjernen vår. Hva gjør de? Da de ble oppdaget, ble de ansett som ikke-(protein)-kodende. Nå, har derimot, forskere ved Hebrew University funnet ut at de faktisk kan kode for proteiner. Artikkelen i ‘Molecular Cell’, "Translation of CircRNAs," -her; åpner opp et nytt vindu av funksjonelle muligheter for disse forskrudde transkripsjoner.
“Sirkulære RNA (circRNAs) er rikelige og evolusjonært konservert RNA av i stor grad ukjent funksjon. Her viser vi at en undergruppe av circRNAs er oversatt i laboratoriet. Ved å utføre ribosom footprinting fra fluehoder, viser vi at en gruppe circRNAs er assosiert med oversettelses ribosomer. Mange av disse ribo-circRNAs som bruker startkodonet til verts-mRNA, er tilknyttet ved membranbundne ribosomer, og har evolusjonært konserverte terminerings kodoner .... Til sammen gir vår studie sterke bevis for oversettelse av circRNAs, og avslører eksistensen av et uutforsket lag av genaktivitet.”
Bilde 3. Sirkulært genom
"Evolusjonært konservert," selvfølgelig, betyr ikke utviklet. En lekmann beretning i Science Daily-her; forklarer betydningen av dette funnet.
“Denne oppdagelsen avslører et uutforsket lag av genaktivitet i en type molekyl som en ikke tidligere har tenkt produserte proteiner. Det viser også at det foreligger et nytt univers av proteiner som ennå ikke er fastlagt.
En mulig funksjon for circRNAs er stabil lagring av protein-kodende data for regioner langt fra kjernen. Spissen av aksoner, for eksempel, kan være for langt unna rask tilgang til gener de trenger. "Som circRNAs er ekstremt stabile, kan de potensielt lagres i lang tid i avdelinger fjernere til cellelegemet lik nervetråder (axons)", sier Science Daily. "Der kan RNA-molekyler tjene som et reservoar for proteiner som blir produsert på et gitt tidspunkt." En forsker ikke knyttet til forskningen uttrykte spenning ang. det: "Dette er en svært viktig, lovende og rettidig oppdagelse som gir et viktig hint av funksjonen til disse rikelige, ennå ubestemte RNAs."
Modifikasjoner -gjensidig avhengige av hverandre
I det genetikere utforsker universet av epigenetiske modifikasjoner, så har de ikke vært i stand til å gjenskape noen av dem i laboratorie-omgivelser (in vitro). Nå har en grunn til dette kommet frem i lyset. En artikkel i Nature begynner med en overraskende statistikk over antall kjente epigenetiske modifikasjoner. Deretter fortelle forfatterne hvordan de oppdaget et tilfelle av "gjensidig avhengige" modifikasjoner:
Nukleinsyrer som gjennomgår naturlig forekommende kjemiske modifikasjoner. Over 100 forskjellige modifikasjoner er blitt beskrevet og enhver posisjon i purin- og pyrimidinbaser kan modifiseres; ofte sukker er også endret. Til tross for nylige fremskritt, er mekanismen for biosyntesen av de de fleste modifikasjoner ikke fullt ut forstått, på grunn av, blant annet, vanskeligheten i forbindelse med rekonstituering av enzymaktivitet i laboratoriet. Mens enkelte modifikasjoner effektivt kan dannes med rensede komponenter, kan andre kreve mer innviklede veier. En modell for gjensidig avhengighets modifikasjon, hvor en modifikasjon er en forutsetning for en annen, forklarer potensielt en betydelig hindring i rekonstituering av enzymatisk aktivitet i laboratoriet. Denne modellen ble tilskyndet av den tidligere oppdagelse av tRNA cytosin-til-uridin redigering i eukaryoter, en reaksjon som ikke er blitt rekapitulert i reagensrør og der mekanismen fortsatt er ukjent.
 Sikkert nok, fant de en sak i en mikrobe der en modifikasjon var en forutsetning for en annen variant. Mekanismen ser ut til å gi kvalitetskontroll ved å hindre katastrofale endringer til hver samsvarende flekk i et helt genom.
Sikkert nok, fant de en sak i en mikrobe der en modifikasjon var en forutsetning for en annen variant. Mekanismen ser ut til å gi kvalitetskontroll ved å hindre katastrofale endringer til hver samsvarende flekk i et helt genom.
Her er en sak vi kan forholde seg til. Det menneskelige immunsystemet muterer hurtig sekvenser på jakt etter matcher til antigener. Hvordan foretar Aktivets-Indusert cytidinDeaminase (AID) deaminerer immunglobulin-reseptorer (IgG) uten å påvirke resten av genomet?
Bilde 4. DNA-replikasjon
Svaret kan innebære gjensidig avhengige modifikasjoner:
“I pattedyrceller spiller AID en kritisk rolle i antistoffklasse spredning spesielt rettet mot IgG-reseptorgener, mens det vanligvis etterlater resten av genomet lytefritt. Selv om mekanismen for dette enzym er blitt klarlagt, er grunnlaget for dets programmerte spesifisitet mot bare en brøkdel av genomet fortsatt uklart. Arbeidet som presenteres her gir en begrunnelse for styring av mutagene enzymer gjennom deres interaksjon med andre partnere, som det er blitt foreslått tidligere. Dette fører selvfølgelig til spørsmålet om hvordan slike substratspesifisiteter utviklet seg. Våre data antyder at svaret kan være relatert til evnen til visse protein-protein-interaksjoner for å tilveiebringe sekundære funksjoner, basert på ekstrem gjensidig avhengighet, som illustrert her ved samspillet mellom TRM140a og ADAT2 / 3.
ID- talsmenn er sikre i å fange opp uttrykkene "programmert spesifisitet" og "ekstrem gjensidig avhengighet" til støtte for sitt syn, mens en humrer over Darwinisters dilemma om ‘hvordan slike substrat-spesifiteter utviklet seg.’ Deres forslag til løsning ser bare ut til å grave en dypere hull. De når aldri helt fram i å fortelle leserne hvordan "ekstreme gjensidig pålitelighet" kom opp med "sekundære funksjoner" av ren flaks, slik at resultatet bare gir et skinn av "programmert spesifisitet." ID, gir derimot, en fornuftssvar. Programmering forutsetter en programmerer.
Oversatt av Asbjørn E. Lund
(Bildene sto ikke i opprinnelig artikkel, evt. untatt det 1., og er satt inn av undertegnede, se lenke i Bilde-nr)
 Elektrisk DNA, sirkular RNA og andre epigenetiske undre
Elektrisk DNA, sirkular RNA og andre epigenetiske undre Elektrisk DNA, sirkular RNA og andre epigenetiske undre
Elektrisk DNA, sirkular RNA og andre epigenetiske undre En annen -Ome med en egen kode
En annen -Ome med en egen kode Sirkulær RNA
Sirkulær RNA Sikkert nok, fant de en sak i en mikrobe der en modifikasjon var en forutsetning for en annen variant. Mekanismen ser ut til å gi kvalitetskontroll ved å hindre katastrofale endringer til hver samsvarende flekk i et helt genom.
Sikkert nok, fant de en sak i en mikrobe der en modifikasjon var en forutsetning for en annen variant. Mekanismen ser ut til å gi kvalitetskontroll ved å hindre katastrofale endringer til hver samsvarende flekk i et helt genom.