Evolusjon; Intelligent Design
Molekylære maskiner: Bruk fysikk til å gjøre mekanisk arbeid

Bilde 1. DNA-polymerase maskin
De kjemiske reaksjonene de fleste av oss lærte om i videregående eller høyskole innebærer utveksling av elektroner i det elementer hopper omkring og krasjer mot hverandre. Et kloratom har et ekstra elektron i sitt ytre skall (Cl-), og et natriumatom har plass til å akseptere det (Na+). Bang! De to molekylene binder sammen til en enhet av salt (NaCl).
Molekylære maskiner er fundamentalt forskjellige, selv om de også kan bytte elektroner på atomnivå. Cellens maskiner er mye større, for én ting, bygget av forsynt foldede polymerer som består av byggeblosser som selv er store molekyler. Enda viktigere, de har bevegelige deler. De bevegelige delene krever krefter mot andre cellestrukturer, og oppnår det vi alle lærte som den matematiske definisjonen av arbeid: kraft * arm (avstand). Noen krefter er mekaniske, som vist i våre kinesin- og ATP-syntase animasjoner, men noen legger til elektriske krefter eller vandige krefter (hydrofob eller hydrofil). Den beste måten å sette pris på ulike måter celler bruker fysiske krefter på, er å se dem i aksjon. Her er noen eksempler fra nyere litteratur.
 Foldingskammeret
Foldingskammeret
En molekylær maskin kalt GroEL/ES-systemet bidrar til å kaste polypeptider inn i proteiner. Mange proteiner kan brettes uten hjelp, men noen søker en "assistanse/anstand" for hjelp. GroEL/ES gir et privat omkledningsrom for disse proteinene. "ES" -delen knytter seg til det fatformede GroEL-kammeret, som lukker seg lik et lokk over polypeptidet inni. Men det er bare hvor moroa starter. Maskinen frakter faktisk på faste stenger for å hindre proteiner fra feilfolding slik at polypeptidet kan få en ny start. Forskere publiserte i Nature Communications -her, beskrev hvordan dette virker for et protein som heter PepQ, en metalloprotease i E. coli.
"Ved hjelp av kryo-elektronmikroskopi, viser vi at GroEL C-termini gjør fysisk kontakt med PepQ-folde-formidleren og hjelper å holde det dypt inne i GroEL-hulrommet, noe som resulterer i redusert kompakthet av PepQ-monomeren. Våre funn støtter sterkt en aktiv modell av chaperonin-mediert proteinfolding, hvor delvis utfolding av misfoldede mellomprodukter spiller en nøkkelrolle."
GroEL/ES kan håndtere mange forskjellige polypeptider i tillegg til PepQ, noe som gjør det til et multi-funksjons foldekammer - ganske bemerkelsesverdig når du tenker på det. Forskerne fant "betydelig utfolding" på innsiden da maskinen " aktivt forandrer " sitt substrat, "en prosess som avhenger delvis av en direkte, fysisk samhandling " mellom maskin og klienten. "Etterfølgende innkapsling av den delvis utfoldede foldede PepQ-monomeren i GroEL/ES-kammeret, endrer fundamentalt proteinets foldebane, noe som resulterer i et raskere og mer effektivt søk etter den opprinnelige tilstanden." Husker du Doug Axes arbeid om søkerom for proteiner -her?
Bilde 2. Proteinfolding i flere struktur-nivåer
Søppeldykking
Det er på en måte hvilke forskere på Sanford Burnham Prebys Medical Discovery Institute (SBP), sier NewsWise -her, da de tok et "dypere dykk i cellulær søppel". De ønsket å lære mer om cellens mekanisme for resirkulering av deler, kjent som autofagi, en prosess som innebærer å separere søppel og ta den til et resirkulerings-anlegg kalt lysosom. Å vite at problemer med autofagi kan bli involvert med aldring, ønsket forskerne å få en bedre "film" av prosessen enn øyeblikksbilder har gitt så langt:
"Autofagi er en dynamisk, multi-trinns prosess som starter med dannelsen av en dobbelmembran-sac i cellens cytoplasma kalt IsolasjonsMembranen (IM). Disse strukturer omslutter cellulært materiale og rusk, som utvides i størrelse for å danne vesikler kalt AutoFagosomer (AFs). Til slutt smelter AF-ene med lysosomer for å danne autolysosomer (ALs) som fordøyer og frigjør nedbrytingsproduktene for gjenbruk, akkurat som et resirkuleringsanlegg ville gjenopprette innkommende søppel.
"En stor utfordring med å forstå hvordan aldring påvirker autofagi er at forskere har fanget en dynamisk prosess med statiske målinger," forklarer Jessica Chang, Ph.D., tidligere postdoc i Hansens lab, som er hovedforfatter av studien. "Autofagi blir mest overvåket ved å telle antall AF, som egentlig bare gir et øyeblikksbilde av prosessen -som kan sammenlignes med hvordan å telle antall søppelbåter på gaten, ikke forteller deg hvor mye søppel som faktisk blir resirkulert på anlegget. Og typisk eldre organismer har et økt antall AF, men vi vet ikke nøyaktig hvorfor."
Så de gikk til arbeid og lagde flere rammer til "filmen" ved å telle AP i ulike celletyper i rundormer. De publiserte sine resultater i eLife -her , men det høres ut som om det er mye mer å lære. Det som er viktig er at her er en annen multifunksjonsmaskin, som går utover enkel kjemi for å gjøre fysisk arbeid i cellen, akkurat som en søppelbil isolerer all slags søppel, sorterer den, og prøver å omarbeide den.
 Arbeidere inne i en blodplate
Arbeidere inne i en blodplate
Husker du Michael Behes overveldende beskrivelse av blodkollaps-kaskaden i sin historiske ID-bok Darwin's Black Box ? Et nytt papir i Nature Scientific Reports graver litt dypere inn i dette eksemplet av irreduserbar kompleksitet, med fokus på bare ett lite aspekt: form-forandringer i blodplate celler når de sprer seg ut for å danne et koagulat.
Form-endringene "skjer-ikke-bare" på en tilfeldig måte. De styres av molekylære maskiner: spesifikt dynein og myosin. Disse er "vandrende" motorer som utfører fysisk arbeid. Når en blodplate blir utsatt for en rift i blodåre-veggen, akkumuleres blodplater ved riften og begynner å spre seg ut på grunn av virkningen av disse motoriske proteiner. I tillegg gir dynamiske fremspring som kalles filopodier og overflater som kalles lamellipodi, tilkoblingspunkter for voksende koagulat, og gjør at materialet vokser til et slags klebemiddel.
Bilde 3. Celle-arbeideren: dynein
Forskerne fant at trombin, et multifunksjonsenzym som er nevnt i Behe's bok, spiller en nøkkelrolle i å utløse noen av de fysiske forandrings-endringene i blodplaten. Trombin er selv en stor, kompleks maskin med fire domener dannet av andre molekylære maskiner. Se på all fysikk som skjer når den slår på maskiner i blodplate:
"Blodplateaktivering, forårsaket av agonister som trombin eller ved kontakt med det ekstracellulære hulrommet, fører til adhesjon, aggregering og koagulering av blodplater. Aktiverte blodplater gjennomgår forandringer, festes og spres på stedet for skade for å danne et koagulat. Vi undersøkte morfologien og morfologisk dynamikk av menneskelige blodplater etter fullstendig spredning ved hjelp av hurtig skannings ione-ledningsmikroskopi. I motsetning til ustimulerte blodplater, viste trombinstimulerte blodplater økt morfologisk aktivitet etter spredning og viste dynamiske morfologiske forandringer i form av bølgelignende bevegelser av lamellipodium og dynamiske fremspring på blodlegemet. Økningen i morfologisk aktivitet var avhengig av trombinkonsentrasjon."
Fjærlignende kanal
Video om molekylære maskiner for følelse/berøring -her.
 Nylig så vi på mekanisk omforming i berøringsfølelse -her. En av kanalene i cellemembranen som åpner for slippe ioner ut etter tur, viser seg å virke som en molekylær fjær. Phys.org inneholder et animert diagram av NOMPC ("nomp-see")-her; som fungerer i en flues følelse av berøring og hørsel. (Se toppen av dette innlegget.) Kanalen består av fire enheter som hver ser ut til å reagere på mekanisk trykk som en fjær. Forskere fra University of California, publiserer sine funn i Nature -her, mener at når fjæren er komprimert, åpnes kanalen for å la ioner strømme. Dette ville være fornuftig, for å svare på berøring, må kanalene bli direkte trukket eller vridd åpne av mikroskopiske krefter på en eller annen måte, men mer arbeid vil være nødvendig for faktisk å bevitne fysikken i aksjon.
Nylig så vi på mekanisk omforming i berøringsfølelse -her. En av kanalene i cellemembranen som åpner for slippe ioner ut etter tur, viser seg å virke som en molekylær fjær. Phys.org inneholder et animert diagram av NOMPC ("nomp-see")-her; som fungerer i en flues følelse av berøring og hørsel. (Se toppen av dette innlegget.) Kanalen består av fire enheter som hver ser ut til å reagere på mekanisk trykk som en fjær. Forskere fra University of California, publiserer sine funn i Nature -her, mener at når fjæren er komprimert, åpnes kanalen for å la ioner strømme. Dette ville være fornuftig, for å svare på berøring, må kanalene bli direkte trukket eller vridd åpne av mikroskopiske krefter på en eller annen måte, men mer arbeid vil være nødvendig for faktisk å bevitne fysikken i aksjon.
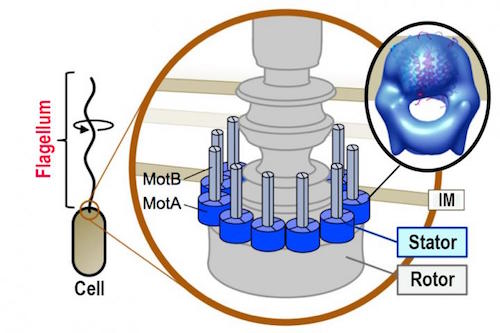
Flagellens rømnings-tricks
Bilde 4. Skisse av bakterieflagellen
Vi kan ikke glemme det ikoniske bakterielle flagellumet i en artikkel om molekylære maskiner - en annen maskin som ble berømt av Michael Behe. Harvard flagellum-forsker Howard Berg, nevnt av Scott Minnich i 'Unlocking the Mystery of Life,' -her, gjennomgår fortsatt papirer om flagellen etter alle disse årene, og en ny i Proceedings of the National Academy of Sciences -her, har vist noe helt unikt og interessant: triket for å unnslippe. Tyske forskere så hvordan en bakterie-flagell kommer ut av en felle. Den setter ikke bare motoren i revers. Her er hva den gjør:
"Det har lenge vært fastslått at flagellen gir et effektivt bevegelsesmiddel for bakterier i planktoniske omgivelser (fri svømming) eller på tvers av overflater (sverming). Det er imidlertid lite som er kjent i forhold til bakteriell motilitet i strukturerte miljøer. I denne studien demonstrerer vi at polare bakterie-flageller kan utnytte en polymorf ustabilitet i flagellar-filamentet til en tredje type flagellar-befordret bevegelse, der flagellumet vikler seg rundt cellekroppen og cellene rygger ut fra smale passasjer i en skruliknende bevegelse."
Vi stopper her, fordi det er vanskelig å toppe det!
Forståelse av molekylære maskiner er fremtidens biologi. Her har vi sett fem eksempler på komplekse maskiner, sammensatt av nøyaktig sekvenserte aminosyrer kodet av DNA, som bruker fysiske krefter til å utføre mekanisk arbeid. Vi kan forholde oss til de fysiske prinsippene (fjærer, skruer og styrte trykk og trekker) i vår egen erfaring med maskiner, noe som fører til en naturlig slutning til intelligent design. Men å finne disse tingene i virksomhet i levende celler på nanometer-nivå - det er noe annet igjen, og ganske spennende.
For ATP-motoren -se her.
Oversatt av Asbjørn E. Lund som også har lagt inn bildene -se evt. lenke i Bildenr.


 Foldingskammeret
Foldingskammeret Arbeidere inne i en blodplate
Arbeidere inne i en blodplate Nylig så vi på mekanisk omforming i berøringsfølelse -her. En av kanalene i cellemembranen som åpner for slippe ioner ut etter tur, viser seg å virke som en molekylær fjær. Phys.org inneholder et animert diagram av NOMPC ("nomp-see")-her; som fungerer i en flues følelse av berøring og hørsel. (Se toppen av dette innlegget.) Kanalen består av fire enheter som hver ser ut til å reagere på mekanisk trykk som en fjær. Forskere fra University of California, publiserer sine funn i Nature -her, mener at når fjæren er komprimert, åpnes kanalen for å la ioner strømme. Dette ville være fornuftig, for å svare på berøring, må kanalene bli direkte trukket eller vridd åpne av mikroskopiske krefter på en eller annen måte, men mer arbeid vil være nødvendig for faktisk å bevitne fysikken i aksjon.
Nylig så vi på mekanisk omforming i berøringsfølelse -her. En av kanalene i cellemembranen som åpner for slippe ioner ut etter tur, viser seg å virke som en molekylær fjær. Phys.org inneholder et animert diagram av NOMPC ("nomp-see")-her; som fungerer i en flues følelse av berøring og hørsel. (Se toppen av dette innlegget.) Kanalen består av fire enheter som hver ser ut til å reagere på mekanisk trykk som en fjær. Forskere fra University of California, publiserer sine funn i Nature -her, mener at når fjæren er komprimert, åpnes kanalen for å la ioner strømme. Dette ville være fornuftig, for å svare på berøring, må kanalene bli direkte trukket eller vridd åpne av mikroskopiske krefter på en eller annen måte, men mer arbeid vil være nødvendig for faktisk å bevitne fysikken i aksjon.