 Irreduserbar kompleksitet i molekylær maskin-sammensetning
Irreduserbar kompleksitet i molekylær maskin-sammensetning
Evolution news; 19. mars 2018
Oversatt herfra.
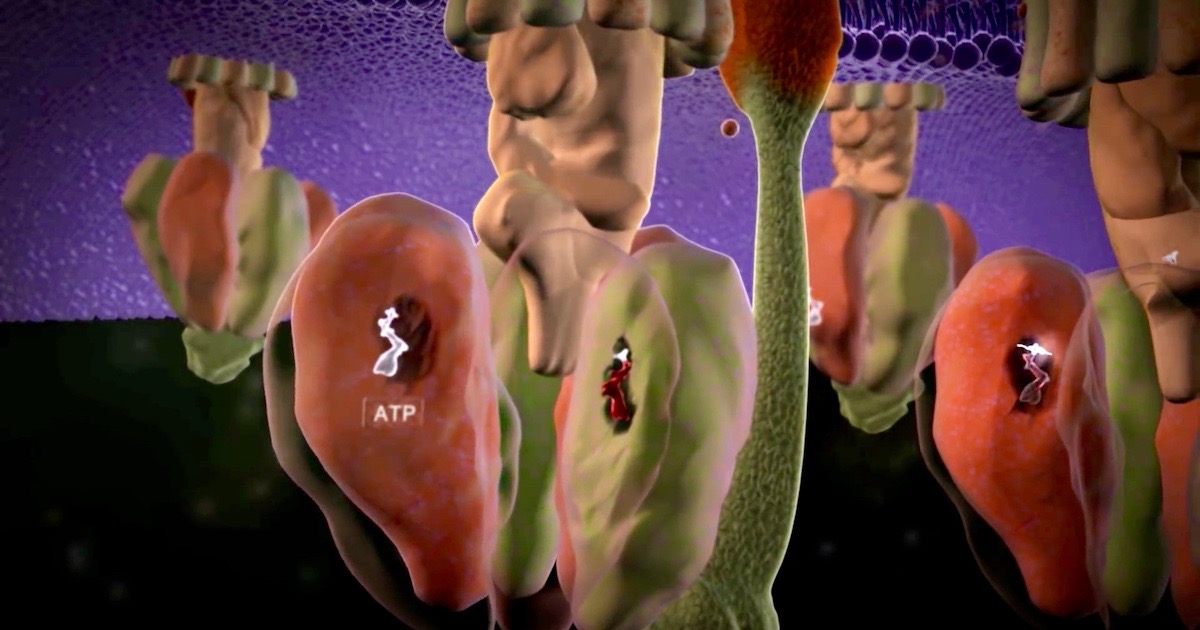
Bilde1: ATP produksjon: Cellens kraftverk, via Discovery Institute.
Vi vet at mange molekylære maskiner er Irreduserbar komplekse (IRK) i deres funksjon. Enda mer IRK er prosessen med å produsere dem i cellen. Et godt eksempel på dette er prosessen med å bygge vår gode gamle standby-maskin, ATP-syntase (se vår animasjon for å gjenkjenne F0- den roterende delen og F1- syntese-delen) -her.
En ny "tour de kraft" -artikkel av He et al. I prosessen ved National Academy of Sciences (PNAS), medforfatter av Nobelprisvinneren John E. Walker (som i en alder av 77 fortsatt forsker på disse små rotasjonsmotorer), beskriver ny innsikt i hvordan disse flerdelte maskinene samles. I en følgekommentar på PNAS -her fremstiller tre forskere (Sang, Pfanner og Becker) det helt klart: "Montering av mitokondriell ATP-syntase er en komplisert prosess som involverer koordinert forening av mitokondrielle og nukleære kodede underenheter." Her er en test på hva det betyr -ikke bekymre deg, dette kommer ikke på prøven :-)
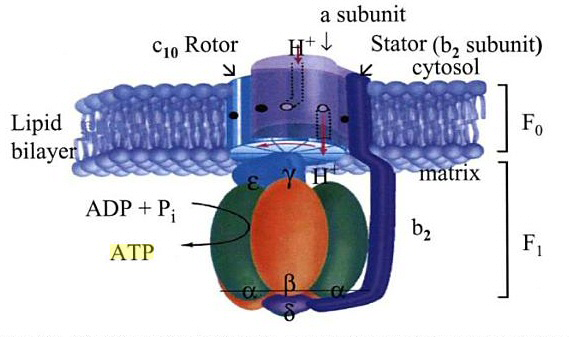 Basert på sine funn [He et al .], foreslår de en elegant modell på hvordan membranområdet av menneskelig ATP-syntase er bygget (se bilde 2). I en gren forbinder et F1- c-ring-mellemprodukt med perifer stengel og de supernumerære underenheter e og g. I den andre grenen samler F1-domenet først sammen med perifert stilk og supernumerære underenheter e, g og f. Begge banene fusjonerer i en mellomliggende nøkkelforbindelse som inneholder F1-domenet, c-ringen, den perifere stengelen og de supernumerære underenhetene epsilon, gamma og H. I alle disse vestigiale [dvs. ufullstendige] ATP-syntase komplekser, er det inhibitoriske protein IF1 anriket for å forhindre ATP-hydrolyse ved hjelp av den ukoblede ATP-syntasen. Tilstedeværelsen av de supernumerære underenhetene epsilon, gamma og H er avgjørende for den påfølgende integrasjon av de mitokondrielt kodede underenheter ATP6 og ATP8 som stabiliseres ved tilsetning av 6,8PL. Således dannes den protonledende kanal mellom ATP6 og c-ringen. På dette stadiet kobles ATP-syntese til proton-bevegelses kraften og det inhibitoriske protein IF1 frigjøres. Til slutt blir DAPIT tilsatt til samlebåndet for å fremme dimerisering og oligomerisering av ATP-syntasen.
Basert på sine funn [He et al .], foreslår de en elegant modell på hvordan membranområdet av menneskelig ATP-syntase er bygget (se bilde 2). I en gren forbinder et F1- c-ring-mellemprodukt med perifer stengel og de supernumerære underenheter e og g. I den andre grenen samler F1-domenet først sammen med perifert stilk og supernumerære underenheter e, g og f. Begge banene fusjonerer i en mellomliggende nøkkelforbindelse som inneholder F1-domenet, c-ringen, den perifere stengelen og de supernumerære underenhetene epsilon, gamma og H. I alle disse vestigiale [dvs. ufullstendige] ATP-syntase komplekser, er det inhibitoriske protein IF1 anriket for å forhindre ATP-hydrolyse ved hjelp av den ukoblede ATP-syntasen. Tilstedeværelsen av de supernumerære underenhetene epsilon, gamma og H er avgjørende for den påfølgende integrasjon av de mitokondrielt kodede underenheter ATP6 og ATP8 som stabiliseres ved tilsetning av 6,8PL. Således dannes den protonledende kanal mellom ATP6 og c-ringen. På dette stadiet kobles ATP-syntese til proton-bevegelses kraften og det inhibitoriske protein IF1 frigjøres. Til slutt blir DAPIT tilsatt til samlebåndet for å fremme dimerisering og oligomerisering av ATP-syntasen.
Bilde 2. ATP-produksjons turbin
Hvorvidt du kan følge sjargongen eller ikke er ikke så viktig som det de bevitnet: en "elegant" prosess som krever presis timing og koordinering. Forskjellige maskindeler må ankomme etter planen og samle seg i mellomliggende (rudimentære) former som ikke er funksjonelle alene. Et inhibitorprotein sørger for at maskinen ikke slås på før planen. Den protonledende kanalen må dannes akkurat slik at den ikke "lekker" protoner. Først når alle delene er klare, begynner maskinen å rotere, men selv da er ikke arbeidet fullført. En annen spiller er "lagt til samlebåndet" for å plassere maskinene på brettene i mitokondrie-membranen (kalt cristae) ved presise vinkler og avstander for optimal produktivitet.
Delene må komme til byggeplassen på tiden. Noen av dem kommer fra kjernen, som må virke som mange km. unna i maskinens skala. Noen er bygd lokalt av gener i mitokondrie-genomet. Interessant er det forskjeller mellom gjær og mennesker i hvilke gener som er kodet hvor, og i hvilken rekkefølge de er dannet. Men beviset på 'puddingen' er i åndedrettet etter å ha spist: begge versjoner av maskinen fungerer effektivt for sine respektive organismer.
 Mellomstrukturen, som likner et stillas som maskinen skal bygges på, er også ikke-reduserbar kompleks: Vi har vist at sammenstillingen av menneskelig ATP-syntase i den indre organell-membran innebærer dannelsen av et monomert mellomprodukt fremstilt fra 25 nukleærkodede proteiner inn i hvilke de to mitokondrielt kodede subenheter er satt inn og deretter forseglet ved assosiasjon av et annet kjernekodet protein, som derved verdsetter (dimerizing) komplekset. Sammensetning av et sluttkjerne-protein oligomeriserer delene sammen tilbake, langs tynne vegger (cristae) inne i mitokondrien.
Mellomstrukturen, som likner et stillas som maskinen skal bygges på, er også ikke-reduserbar kompleks: Vi har vist at sammenstillingen av menneskelig ATP-syntase i den indre organell-membran innebærer dannelsen av et monomert mellomprodukt fremstilt fra 25 nukleærkodede proteiner inn i hvilke de to mitokondrielt kodede subenheter er satt inn og deretter forseglet ved assosiasjon av et annet kjernekodet protein, som derved verdsetter (dimerizing) komplekset. Sammensetning av et sluttkjerne-protein oligomeriserer delene sammen tilbake, langs tynne vegger (cristae) inne i mitokondrien.
Bilde 3. Protein-syntes i ribosomet
Legg merke til at deler fra de forskjellige genomene må jobbe tett sammen. Det er som et produksjonsanlegg som mottar deler lokalt og fra India som må oppfylle avtalte spesifikasjoner for å matche. Det er også regler for import, akkurat som for deler som kommer fra et land langt unna. De kjernekodede delene må passere gjennom to forskjellige kontrollpunkter (mitokondriens indre og ytre membraner), som hver har sitt robot -sikkerhetspersonell for å validere dem og iverksette transport til innsiden.
Tidligere artikkel har vist hvordan den ferdige "fabrikken" av maskiner er organisert innenfor mitokondrion. Et bestemt kjerneprotein forsegler dem i to (deler) i en vinkel, slik at de roterende prototype-pumpene kan maksimere inntaket av protonbrensel, mens F 1- delene, hvor ATP-syntese oppstår, er lenger fra hverandre for ikke å overfylle utgangs molekylene. Et "sluttkjerneprotein" forbinder delene sammen (oligomeriserer dem) langs membrankanter. Den langsgående avstanden er også tett kontrollert, slik at de ikke støter til hverandre. Hvert punkt på produksjonen er programmatisk styrt. Når alt er ferdig, er det ordnet rader av ATP-syntasemotorer som turbiner i en vannkraftverk, som nærer seg på en strøm av protoner produsert av oppstrøms maskiner i respirasjons-transportkjeden.
 Ribosomets sammensetning
Ribosomets sammensetning
Seere av cellulære animasjoner som de som 'Unlocking the Mystery of Life' -her, kan aldri glemme linje -produksjons prosessen inne i ribosomet, hvor nøyaktig sekvenserte messenger-RNAer blir matchet med transport-RNAer som frakter aminosyrer for å danne proteiner. Inngangstunnelene for ingrediensene og utgangstunnelene for polypeptidene, og alt i mellom, må plasseres nøyaktig for å oppnå riktig drift. Ribosomet er absolutt et av de mest fantastiske eksemplene på informasjonsoversettelse i hele naturen. Men hvordan er selve ribosomet bygget?
Bilde 4. Ribosomets sammensetning -grovskisse
Nature -her, har gitt en tidlig versjon av et ikke-redigert manuskript av Sanghai et al. om ribosom montering. Selv om det har blitt akseptert for publisering, vil det bli gjenstand for redaksjonelle revisjoner. Emne-materien ser imidlertid ut til å vise et annet fantastisk tilfelle av ikke-reduserbar kompleksitet i konstruksjonen av denne viktige molekylære maskinen.
Her er abstraktet:
--Tidlige samtidige transkripsjonelle hendelser av eukaryotisk ribosom produksjon resulterer i dannelse av forløpere av de små (40S) og store (60S) ribosomale underenheter. Et flertall av forbigående samlefaktorer regulerer og påser systematisk folding av pre-ribosomale RNA-underdomener. På grunn av begrenset strukturell informasjon er imidlertid rollen til disse faktorene under tidlig nukleolær 60S-samling ikke fullt ut forstått. Her har vi bestemt cryo-EM rekonstruksjoner av den nukleolære pre-60S ribosomal underenheten i forskjellige konformasjonelle tilstander ved oppløsninger på opptil 3,4 Å. Disse rekonstruksjonene avdekker hvordan statisk (steric) hindring og molekyl-etterligning (mimicry) brukes til å forhindre både for tidlig foldingstilstander og binding av senere faktorer. Dette oppnås ved den samordnede aktivitet av 21 ribosomale samlingsfaktorer som stabiliserer og remodellerer pre-ribosomal RNA og ribosomale proteiner. Blant disse faktorene danner tre Brix-domeneproteiner og deres bindingspartnere en ringlignende struktur ved rRNA-domene grenser for å støtte arkitekturen til modningspartikkelen. Gjensidig utelukkende konformasjoner av disse pre-60S-partiklene antyder at dannelsen av polypeptid-utgangstunnelen oppnås gjennom forskjellige sammenleggingsbaner i etterfølgende stadier av ribosom sammenstillingen. Disse strukturene rasjonaliserer tidligere genetiske og biokjemiske data og fremhever mekanismene som driver eukaryotisk ribosom-sammenstilling på en ensrettet måte.
Kravene til IRK er oppfylt i denne beskrivelsen: "En mengde forbigående monteringsfaktorer" regulerer og systematisk folder proteinene som skal brukes til å konstruere maskinen. Forfatterne nevner "21 ribosom-monteringsfaktorer som stabiliserer og ombygger" RNA og proteiner før maskinen er i drift. Inne i det voksende ribosomet inneholder et stillas faktorer for utgangstunnelen på plass. Alt er koreografert i tid og rom med "mekanismer som kjører ... produksjon på en ensrettet måte."
Bilde 5. Ribosomet oversetter mRNA
 Her ser vi mange deler som arbeider sammen på en tidslinje. Delene alene virker ikke individuelt. Du kan få alle proteinene levert til byggeplassen, og ingenting vil skje uten at de programmerte mekanismene setter dem sammen i rekkefølge. Noen deler holder andre på plass, andre styrer folding av proteindeler, og noen forhindrer for tidlig prematur samling. Alle veier for montering av underdomene reguleres av et masterprogram, slik at hver gruppe av trinn følger en "ensrettet" plan mot ferdigproduktet. Det er en fantastisk IRK-samlingsprosess som produserer en IRK-maskin. Hvis fem deler av en musefelle er tilstrekkelig til å indikere IRK, hva med dusinvis av deler, der alle følger en programmessig produksjons-sekvens?
Her ser vi mange deler som arbeider sammen på en tidslinje. Delene alene virker ikke individuelt. Du kan få alle proteinene levert til byggeplassen, og ingenting vil skje uten at de programmerte mekanismene setter dem sammen i rekkefølge. Noen deler holder andre på plass, andre styrer folding av proteindeler, og noen forhindrer for tidlig prematur samling. Alle veier for montering av underdomene reguleres av et masterprogram, slik at hver gruppe av trinn følger en "ensrettet" plan mot ferdigproduktet. Det er en fantastisk IRK-samlingsprosess som produserer en IRK-maskin. Hvis fem deler av en musefelle er tilstrekkelig til å indikere IRK, hva med dusinvis av deler, der alle følger en programmessig produksjons-sekvens?
I 'Unlocking' -her, om montering av bakteriell flagellum, beskrev Paul Nelson hvordan den hierarkiske IRK av maskinmontering i cellen utfordrer darwinistisk teori. "For å konstruere den flagellære mekanismen, eller titusenvis av andre slike mekanismer i cellen , trenger du andre maskiner for å regulere samlingen av disse strukturene. Og disse maskinene krever selv andre maskiner for sin montering." Jonathan Wells traff poenget ved å si: "Hvis en av disse delene mangler eller var satt på feil sted, vil ikke motoren fungere. Så dette apparatet for å sette sammen flagellarmotoren er selv ikke-reduserbart komplekst. Faktisk, er det vi har her ikke-reduserbar kompleksitet (IRK) hele veien."
Oversettelse og bilder ved Asbjørn E. Lund
 Irreduserbar kompleksitet i molekylær maskin-sammensetning
Irreduserbar kompleksitet i molekylær maskin-sammensetning Irreduserbar kompleksitet i molekylær maskin-sammensetning
Irreduserbar kompleksitet i molekylær maskin-sammensetning Basert på sine funn [He et al .], foreslår de en elegant modell på hvordan membranområdet av menneskelig ATP-syntase er bygget (se bilde 2). I en gren forbinder et F1- c-ring-mellemprodukt med perifer stengel og de supernumerære underenheter e og g. I den andre grenen samler F1-domenet først sammen med perifert stilk og supernumerære underenheter e, g og f. Begge banene fusjonerer i en mellomliggende nøkkelforbindelse som inneholder F1-domenet, c-ringen, den perifere stengelen og de supernumerære underenhetene epsilon, gamma og H. I alle disse vestigiale [dvs. ufullstendige] ATP-syntase komplekser, er det inhibitoriske protein IF1 anriket for å forhindre ATP-hydrolyse ved hjelp av den ukoblede ATP-syntasen. Tilstedeværelsen av de supernumerære underenhetene epsilon, gamma og H er avgjørende for den påfølgende integrasjon av de mitokondrielt kodede underenheter ATP6 og ATP8 som stabiliseres ved tilsetning av 6,8PL. Således dannes den protonledende kanal mellom ATP6 og c-ringen. På dette stadiet kobles ATP-syntese til proton-bevegelses kraften og det inhibitoriske protein IF1 frigjøres. Til slutt blir DAPIT tilsatt til samlebåndet for å fremme dimerisering og oligomerisering av ATP-syntasen.
Basert på sine funn [He et al .], foreslår de en elegant modell på hvordan membranområdet av menneskelig ATP-syntase er bygget (se bilde 2). I en gren forbinder et F1- c-ring-mellemprodukt med perifer stengel og de supernumerære underenheter e og g. I den andre grenen samler F1-domenet først sammen med perifert stilk og supernumerære underenheter e, g og f. Begge banene fusjonerer i en mellomliggende nøkkelforbindelse som inneholder F1-domenet, c-ringen, den perifere stengelen og de supernumerære underenhetene epsilon, gamma og H. I alle disse vestigiale [dvs. ufullstendige] ATP-syntase komplekser, er det inhibitoriske protein IF1 anriket for å forhindre ATP-hydrolyse ved hjelp av den ukoblede ATP-syntasen. Tilstedeværelsen av de supernumerære underenhetene epsilon, gamma og H er avgjørende for den påfølgende integrasjon av de mitokondrielt kodede underenheter ATP6 og ATP8 som stabiliseres ved tilsetning av 6,8PL. Således dannes den protonledende kanal mellom ATP6 og c-ringen. På dette stadiet kobles ATP-syntese til proton-bevegelses kraften og det inhibitoriske protein IF1 frigjøres. Til slutt blir DAPIT tilsatt til samlebåndet for å fremme dimerisering og oligomerisering av ATP-syntasen. Mellomstrukturen, som likner et stillas som maskinen skal bygges på, er også ikke-reduserbar kompleks: Vi har vist at sammenstillingen av menneskelig ATP-syntase i den indre organell-membran innebærer dannelsen av et monomert mellomprodukt fremstilt fra 25 nukleærkodede proteiner inn i hvilke de to mitokondrielt kodede subenheter er satt inn og deretter forseglet ved assosiasjon av et annet kjernekodet protein, som derved verdsetter (dimerizing) komplekset. Sammensetning av et sluttkjerne-protein oligomeriserer delene sammen tilbake, langs tynne vegger (cristae) inne i mitokondrien.
Mellomstrukturen, som likner et stillas som maskinen skal bygges på, er også ikke-reduserbar kompleks: Vi har vist at sammenstillingen av menneskelig ATP-syntase i den indre organell-membran innebærer dannelsen av et monomert mellomprodukt fremstilt fra 25 nukleærkodede proteiner inn i hvilke de to mitokondrielt kodede subenheter er satt inn og deretter forseglet ved assosiasjon av et annet kjernekodet protein, som derved verdsetter (dimerizing) komplekset. Sammensetning av et sluttkjerne-protein oligomeriserer delene sammen tilbake, langs tynne vegger (cristae) inne i mitokondrien. Ribosomets sammensetning
Ribosomets sammensetning Her ser vi mange deler som arbeider sammen på en tidslinje. Delene alene virker ikke individuelt. Du kan få alle proteinene levert til byggeplassen, og ingenting vil skje uten at de programmerte mekanismene setter dem sammen i rekkefølge. Noen deler holder andre på plass, andre styrer folding av proteindeler, og noen forhindrer for tidlig prematur samling. Alle veier for montering av underdomene reguleres av et masterprogram, slik at hver gruppe av trinn følger en "ensrettet" plan mot ferdigproduktet. Det er en fantastisk IRK-samlingsprosess som produserer en IRK-maskin. Hvis fem deler av en musefelle er tilstrekkelig til å indikere IRK, hva med dusinvis av deler, der alle følger en programmessig produksjons-sekvens?
Her ser vi mange deler som arbeider sammen på en tidslinje. Delene alene virker ikke individuelt. Du kan få alle proteinene levert til byggeplassen, og ingenting vil skje uten at de programmerte mekanismene setter dem sammen i rekkefølge. Noen deler holder andre på plass, andre styrer folding av proteindeler, og noen forhindrer for tidlig prematur samling. Alle veier for montering av underdomene reguleres av et masterprogram, slik at hver gruppe av trinn følger en "ensrettet" plan mot ferdigproduktet. Det er en fantastisk IRK-samlingsprosess som produserer en IRK-maskin. Hvis fem deler av en musefelle er tilstrekkelig til å indikere IRK, hva med dusinvis av deler, der alle følger en programmessig produksjons-sekvens?